简介
细胞爬片技术自诞生以来,就在不断进化以满足科研人员对组织细微结构及蛋白表达进行精确检测的需求。从手工制作到自动化处理,从简单染色到多重标记,极大提升了实验的精准度和效率。相较于石蜡切片,细胞爬片能更好地保存组织的三维结构和更丰富的表面抗原信息,而相比于冰冻切片,它在多染色的复杂实验中显示出更高的稳定性。常作为免疫组化和免疫荧光检测的检测样本,助力观察特定细胞类型的分布、识别病变细胞以及监测药物对细胞的作用。在肿瘤研究、神经科学、发育生物学等科研领域起到重要作用。
在免疫组化实验中,细胞爬片、石蜡切片和冰冻切片之间在实验流程上存在一些差异,细胞爬片需要做细胞的前培养,无需脱蜡和抗原修复,实验流程主要包括:细胞培养、固定、透膜、封闭、一抗孵育、二抗孵育、酶底物显色或荧光检测、封片观察等步骤。
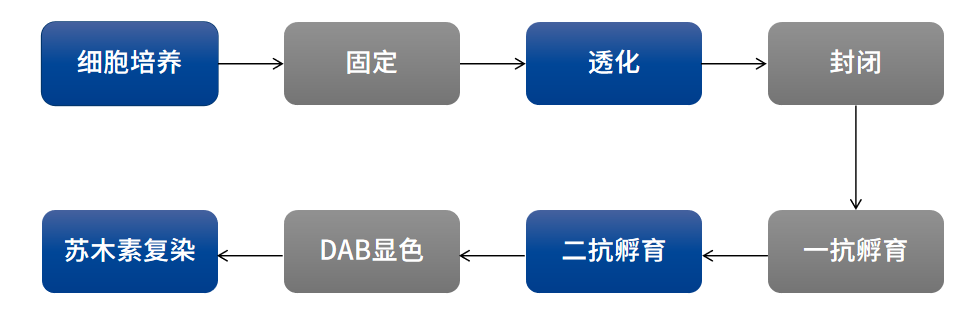
图: 细胞爬片免疫组化染色流程图
材料与仪器
试剂:EDTA(PH9.0) 抗原修复液、PBS 缓冲液、4% 多聚甲醛、BSA、中性树胶、组化试剂盒 DAB 显色剂、一抗和二抗
仪器耗材:显微镜、载玻片、盖玻片、脱色摇床、涡旋混合器、掌上离心机、移液枪等
步骤
以直接取材为例:
1、细胞培养
细胞爬片终止培养后,将爬片浸没在 PBS 中清洗 2 次,每次 5 min。
▲对于贴壁性能不好的细胞,可适当调整减少清洗次数或延长固定时间。
2、固定
细胞爬片用 4% 的多聚甲醛(室温)浸没固定 40 min 至 24 h,或置于冷丙酮中(-20℃)固定 10 min,PBS 清洗 3 次,每次 5 min。
3、透化
加入 0.2% Triton X-100 孵育 10~20 min,PBS 清洗 3 次,每次 5 min。
▲Triton X-100 是常用的通透试剂,可以通透细胞膜和核膜,当应用在抗原表达在细胞膜或核膜时,需控制该通透剂的使用时间,从而减少其对膜蛋白的破坏。
4、封闭处理
a.阻断内源性过氧化物酶:轻甩去载玻片上的液体,用吸水纸吸干爬片周围残留的液体。向孔板中滴加适量内源性过氧化物酶阻断剂,室温孵育 10~20 min,阻断完成后用 PBS 清洗载玻片,清洗 3 次,每次 3 min。
b.滴加正常山羊血清封闭液,室温 20 min,弃掉,勿洗。
5、一抗孵育
根据孔板大小,滴加适量的一抗,4℃ 过夜孵育或室温孵育 1~2 h,孵育完成后,PBS 清洗 3 次,每次 3 min。
6、二抗孵育
滴加适量微聚物二抗,室温孵育 20 min,PBS 清洗 3 次,每次 3 min。
7、DAB显色
DAB 工作液配制:在进行 DAB 显色前配制工作液,每 1 ml DAB Buffer 加入适量 DAB Solution (10×),混匀后,避光保存,建议在 30 min 内用完。滴加适量新配制 DAB 显色液,室温孵育 1~5 min,合理控制反应时间,防止染色过深,染色完成后使用 H2O 冲洗 10 min。
8、复染与反蓝
苏木素染色孵育,染色完成后,使用 H2O 冲洗 10 min。
9、脱水、封片
用 70% 乙醇、80% 乙醇、90% 乙醇、95% 乙醇、无水乙醇和二甲苯各 3 min 脱水。将已透明处理的爬片取出,滴一滴中性树胶爬片中央,缓慢将盖玻片放下并覆盖所有爬片,避免气泡产生,置于通风橱内晾干。
10、阅片